מנהל המזון והתרופות האמריקאי מאפשר טיפול ראשון לצורות נדירות של סרטן העור
מדובר בטיפול ראשוני בקרצינומה גרורתית של תאי מרקל, צורה נדירה ואגרסיבית של סרטן עור. "בעוד שסרטן העור הוא אחת ממחלות הסרטן הנפוצות ביותר, חולים הסובלים מסוג נדיר של סרטן תאי מרקל לא זכו לאפשרות טיפול מאושר עד עתה", אמר ד"ר ריצ'רד פזדור, המנהל של מחלקת מוצרי ההמטולוגיה ואונקולוגיה במרכז להערכה ומחקר של תרופות של מנהל המזון והתרופות האמריקאי
מנהל המזון והתרופות האמריקאי העניק היום אישור מואץ לתרופה Bavencio (אבלומאב) לטיפול בחולים מבוגרים וילדים בני 12 ומעלה בקרצינומה גרורתית של תאי מרקל (MCC), כולל חולים שלא קיבלו טיפול כימותרפי בעבר. זהו הטיפול הראשון שמנהל המזון והתרופות האמריקאי מאשר לטיפול בקרצינומה גרורתית של תאי מרקל, צורה נדירה ואגרסיבית של סרטן עור.
"בעוד שסרטן העור הוא אחת ממחלות הסרטן הנפוצות ביותר, חולים הסובלים מסוג נדיר של סרטן תאי מרקל לא זכו לאפשרות טיפול מאושר עד עתה," אמר ד"ר ריצ'רד פזדור, המנהל של מחלקת מוצרי ההמטולוגיה ואונקולוגיה במרכז להערכה ומחקר של תרופות של מנהל המזון והתרופות האמריקאי והמנהל של המרכז למצוינות באונקולוגיה של מנהל המזון והתרופות האמריקאי. "הקהילה המדעית ממשיכה להביא להתקדמות בהתמקדות במנגנוני המערכת החיסונית של הגוף על מנת לטפל בסוגים שונים של סרטן. התקדמות זו מובילה לטיפולים חדשים גם בצורות נדירות של סרטן בהן אפשרויות הטיפול מוגבלות או לא קיימות."
לפי המכון הלאומי לסרטן כ-1600 איש בקירוב בארה"ב מאובחנים כחולי MCC בכל שנה. מרבית החולים סובלים מגידולים לוקליים הניתנים לטיפול באמצעות כריתה כירורגית, אך כמחצית מכל החולים חווים הישנות של המחלה, ויותר מ-30 אחוזים יפתחו, בסופו של דבר, סרטן גרורתי. בקרב חולים בקרצינומה גרורתית של תאי מרקל, הסרטן התפשט לחלקים אחרים בגוף.
Bavencio שמה לה ליעד את נתיב ה-PD-1/PD-L1 (חלבונים הנמצאים בתאי המערכת החיסונית של הגוף ובכמה תאים סרטניים). באמצעות חסימה של אינטראקציות אלה, Bavencio עשויה לסייע למערכת החיסונית של הגוף לתקוף את התאים הסרטניים.
Bavencio קיבלה אישור מואץ המאפשר למנהל המזון והתרופות האמריקאי לאשר תרופות למצבים חמורים כדי למלא בצורך רפואי בלתי מסופק על ידי נתונים של ניסוי קליני, שנחשבים כמנבאים של יתרון רפואי לחולים. ניסויים קליניים נוספים נדרשים כדי לאמת את היתרון הרפואי של Bavencio ונותן החסות עורך עתה מחקרים אלה.
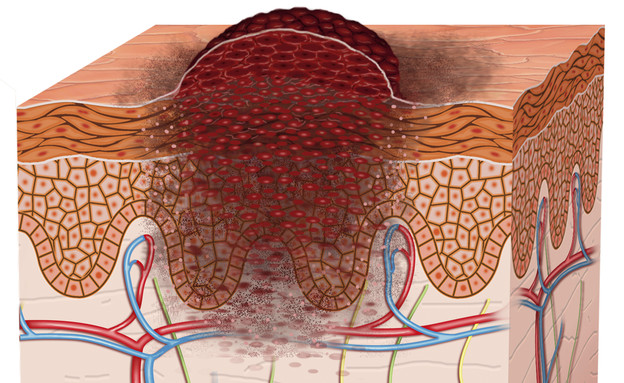
33 אחוז חוו צמצום מלא או חלקי של הגידולים
האישור ש-Bavencio קיבלה היום מתבסס על נתונים של ניסוי בעל זרוע אחת של חולי MCC שבעבר עברו לפחות משטר טיפול כימותרפי אחד. הניסוי מודד את אחוז החולים שחוו צמצום מלא או חלקי של הגידולים שלהם (שיעור תגובה כולל) ועבור חולים עם תגובה, אורך הזמן שהגידול היה תחת שליטה (משך התגובה). מתוך 88 החולים שטופלו ב-Bavencio במהלך הניסוי, 33 אחוזים חוו צמצום מלא או חלקי של הגידולים. התגובה נמשכה יותר משישה חודשים ב-86 אחוזים מתוך החולים שהגיבו לתרופה וביותר מ-12 חודשים בקרב 45 אחוזים מקרב החולים שהגיבו לה.
תופעות לוואי נפוצות של Bavencio כוללות עייפות, כאבי שרירים ושלד, שלשול, בחילה, תגובות הקשורות לאינפוזיה, פריחה, חוסר תיאבון ונפיחות בגפיים (בצקת פריפריאלית). מרבית הסיכונים החמורים של התרופה הם כתוצאה ממערכת החיסון, כאשר המערכת החיסונית של הגוף תוקפת תאים או איברים בריאים, כמו הריאות (פנאומיניטיס), הכבד (צהבת), המעי הגס (דלקת מעי הגס), בלוטות המפיקות הורמונים (אנדורקינופתיה) והכליות (דלקת כליות). בנוסף לכך, קיים סיכון לתגובות חמורות הקשורות לאינפוזיה. על חולים הסובלים מתגובות החמורות או מסכנות חיים הקשורות לאינפוזיה להפסיק לצרוך את התרופה. לנשים בהיריון או נשים מניקות אסור לצרוך את התרופה מפני שהיא עלולה להזיק להתפתחות העובר או לרך הנולד.
ה-FDA מעניק סקירת עדיפות זו והקצאת טיפול פורץ דרך. Bavencio קיבלה גם הקצאת תרופה יתומה, המספקת תמריצים כדי לסייע ולעודד פיתוח תרופות למחלות נדירות.
מנהל המזון והתרופות האמריקאי העניק אישור מואץ של Bavencio ל-EMD Sereno Inc.
מנהל המזון והתרופות האמריקאי, סוכנות בתוך משרד הבריאות האמריקאי, מגן על בריאות הציבור באמצעות הבטחת הבטיחות, יעילות, וביטחון של תרופות המיועדות לבני אדם ובעלי חיים, חיסונים ומוצרים ביולוגיים אחרים לשימוש בני אדם, ומכשירים רפואיים. הסוכנות גם אחראית על הבטיחות והביטחון של אספקת המזון, מוצרי הקוסמטיקה, תוספי מזון ומוצרים בעלי קרינה אלקטרונית, ופיקוח על מוצרי טבק במדינה.